|
 |
 |
 |
 |
 |
1. Physikalische Eigenschaften |
 |
|
|
Versuche |
|
|
|
Betrachtet man ein durchsichtiges Einwegfeuerzeug, so erkennt man leicht eine flüssige und eine gasförmige Phase (Phase = einheitlicher Bereich in einem Gemisch), die miteinander in einem Gleichgewicht stehen. Entnimmt man dem Feuerzeug Gas, so verdampft etwas von der Flüssigkeit nach. Der Vorteil dieser Anordnung ist, dass eine bestimmte Gasportion im flüssigen Zustand ein geringeres Volumen beansprucht als im Gaszustand, so kann man viel mehr Brennstoffs auf kleinem Raum unterbringen. Beim "Feuerzeuggas" handelt es sich um ein Gas - oder Gasgemisch - das sich unter Druck verflüssigen lässt. |
Verflüsigung unter
Druck |
Feuerzeuggas lässt sich mit einem Druck von xx bar verflüssigen. In einem Einwegfeuerzeug herrscht somit ein Überdruck von genau diesem Druck.
Man füllt die Spritze mit dem "Feuerzeuggas", verschließt sie mit einen Verschlussstopfen und komprimiert kräftig. Es lassen sich winzige farblose Flüssigkeitstropfen erkennen, die beim Entspannen wieder verschwinden. Es stellt sich das ursprüngliche Gasvolumen wieder ein.
Das Experiment lässt sich deuten, wenn man davon ausgeht, dass zwischen den Teilchen im gasförmigen Zustand Anziehungskräfte herrschen. Diese sind recht schwach und haben nur eine sehr geringe Reichweiten. Es handelt sich um die Van-der-Waals-Kräfte, deren Stärke von der Größe und Art der Moleküle abhängen. Im gasförmigen Feuerzeuggas sind sie vorhanden, können jedoch nicht wirken, da die Moleküle zu weit voneinander entfernt sind. Durch das Komprimieren werden die Abstände zwischen den Molekülen kleiner und die Van-der-Waals-Kräfte können wirksam werden; das Gas wird flüssig. |
Verflüssigung durch
Abkühlen |
Feuerzeuggas wird bei einer Temperatur von -xx °C flüssig! D.h. die Siedetemperatur liegt bei ca. -xx °C.
Es ist zu vermuten, dass durch eine Temperaturerniedrigung die Bewegung der Teilchen stark eingeschränkt wird, und auch so eine Verflüssigung möglich ist.
Man füllt die Spritze mit dem "Feuerzeuggas", verschließt sie mit einen Verschlussstopfen und stellt sie in ein Kältebad (ca. -12 °C), das durch Mischen vom Salz, Eis und Wasser (je 1/3) hergestellt wird. Bei leichtem Druck auf den Stempel wird das Gas flüssig. Beim Erwärmen mit der Hand stellt sich der Ausgangszustand wieder ein. |
Dichte von Feuerzeuggas
"Feuerzeuggas" ist schwerer
als Luft (Umgießen)
Bestimmung der Dichte
von "Feuerzeuggas" |
Im nebenstehenden Versuch soll geklärt werden, ob Feuerzeuggas leichter oder schwerer als Luft ist. Dies ist wichtig zu wissen, wenn man in tiefliegenden Kellerräumen mit Campingkochern o.ä. hantiert (Explosionsgefahr durch Gas/Luft-Gemische).
Das Experiment zeigt, dass die Dichte von Feuerzeuggas doppelt so groß wie die von Luft; d.h. das Gas sinkt zu Boden. Deshalb dürfen in Kellerbereichen keine Flüssiggasflaschen gelagert werden.
Die Dichte von Feurzeuggas beträgt: Dichte = xx g/L
Hinweis: Die Dichte von Gasen wird in g/L angegeben, nicht in g/mL wie bei Feststoffen oder Flüssigkeiten
|
Weshalb muss die Spritze vor der
Massenbestimmung des Gases
evakuiert werden? |
|
|
|
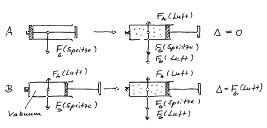
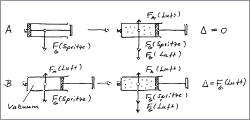
Fall A:
Die Leermasse der Spritze wird bei eingeschobenem Stempel bestimmt. Danach wird ein bestimmtes Volumen Luft eingezogen und die Masse erneut bestimmt.
Fall B:
Die verschlossene Spritze wird durch durch Herausziehen des Stempels evakuiert und der Stempel in dieser Lage mit einem quer eingeschobenen Nagel fixiert. Man bestimmt so die Leermasse. Danach wird die Spritze mit Luft gefüllt und erneut (natürlich mit Nagel) gewogen.
Im Fall A wird kein Unterschied in der Anzeige der Waage auftreten. Zur Gewichtskraft der Spritze addiert sich die Gewichtskraft der eingezogenen Luft. Gleichzeitig erfährt die Spritze eine Auftriebskraft, die genau so groß ist wie die Gewichtskraft der verdrängten Luft. Die resultierende Gewichtsdifferenz ist also Null.
Im Fall B erfährt die Spritze mit dem Vakuum eine Auftriebskraft. Die resultierende Massendifferenz entspricht der Gewichtskraft der eingezogenen Luft.
|
|
|
|
|
 |
 |
Masse von Gasen |
 |
|
 |
 |
Vergrößern durch Klicken |
|
 |
 |
|
 |
 |
|
 |